蛋白质介导了生命体的大多数生理过程,其生物学功能很大程度由其空间三维结构决定。因此,从头设计一个蛋白质或改造一个活性位点,便有可能创造出自然界中不存在的具有特定功能的蛋白质,获得催化特定化学反应的新型蛋白酶。
硒酶是一类以硒代半胱氨酸(Sec)作为催化必须基团的蛋白质,以谷胱甘肽过氧化物酶(GPx)为例,它能将谷胱甘肽(GSH)作为还原剂,催化过氧化物(ROOH)转变为无毒性的羟基化物(ROH),且活性受到体内磷酸酶和酪氨酸激酶的严格调控,以保护细胞免受氧化损伤。由于硒酶异源表达困难、半衰期短等问题,极大限制了其在生物医学方面的应用,因而制备高效可控的智能型GPx模拟物受到人们的关注。
吉林大学理论化学研究所罗全教授课题组,突破了传统利用同源蛋白质骨架构筑硒酶的局限性,利用理论计算与模拟,在原子精度上研究Ca2+响应的恢复蛋白(Rn)的动态结构,及其与底物GSH的分子识别机制,指导蛋白质工程的精准改造,成功构筑了一种活性和调控性可与天然酶媲美的人工GPx酶(Angew. Chem. Int. Ed. 2014, 53, 13536)。该工作为基于非同源蛋白骨架构筑刺激响应性人工硒酶提供了重要的理论依据。在此工作基础上,罗全教授等人进一步提出了“催化、识别与微环境多因素协同仿酶”的新思路。通过计算对接虚拟筛选、分子动力学模拟和结合自由能计算,实现了催化基团(Sec128)、底物识别基团(Arg50)和静电微环境(Arg46,Arg71和Lys131)在Rn表面的合理配置,使其最大程度与天然GPx酶活性位点结构相似,赋予了Rn高效的硒酶活性,以及对底物GSH的专一性。

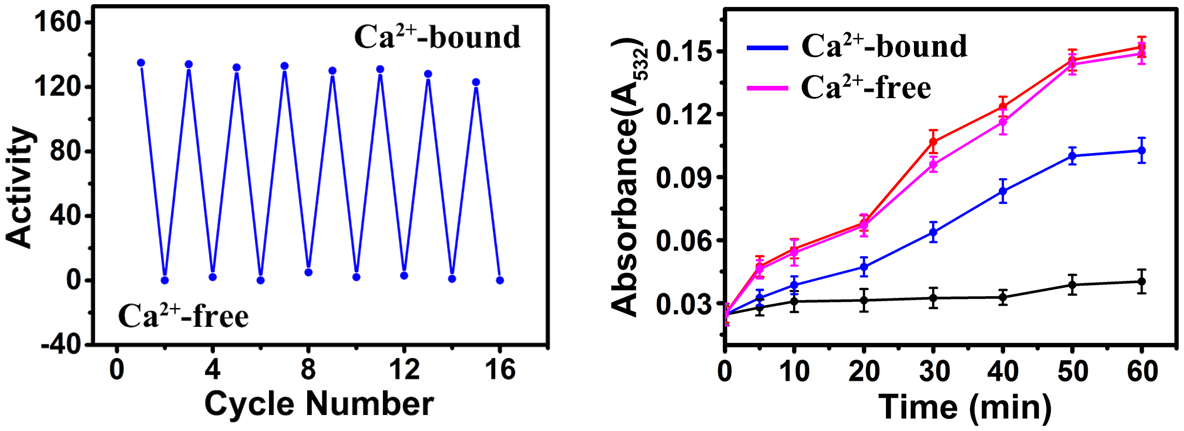
发现将新设计的催化位点与Rn的别构部位偶合,可以利用Ca2+触发该位点的“解构”与“重构”过程,使其GPx酶活性具备非常稳定的环境自适应循环调控能力,且响应浓度达到感受细胞内Ca2+浓度变化的微摩尔级水平,并对细胞线粒体损伤模型表现出优异的Ca2+响应性抗氧化效果。
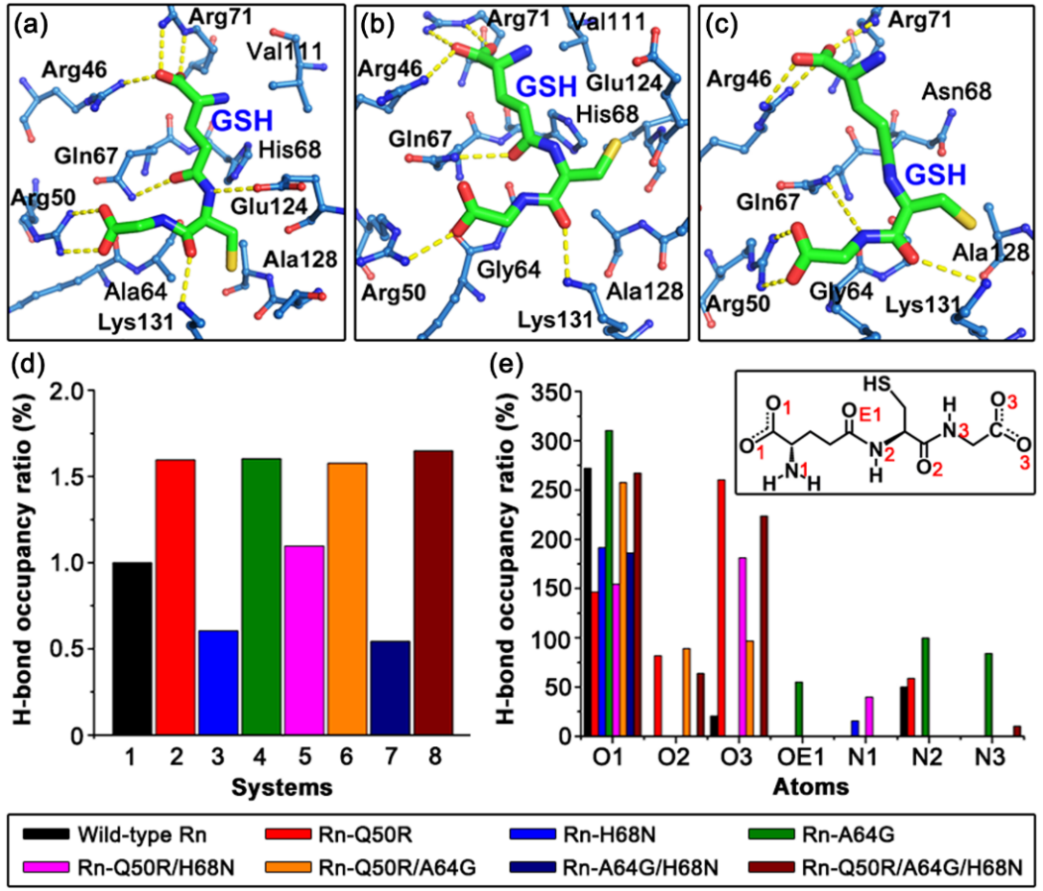
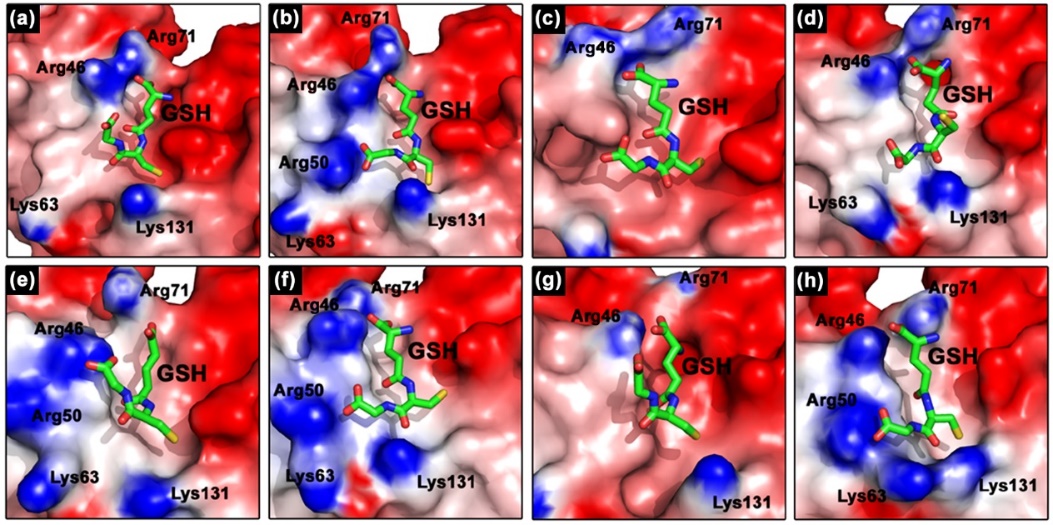
进一步阐明了人工酶催化中心结构、表面静电分布、氢键、范德华作用等对其底物识别机制的影响,包括Q50R突变通过氢键和静电相互作用直接参与GSH识别;A64G突变导致活性位点的局部构象变化,进而影响Rn表面电荷分布,提升其底物识别能力。
相关工作在Chemistry-A European Journal作为封面热点文章发表(Chem. Eur. J. 2019, 25, 10350.)
文章链接:https://onlinelibrary.wiley.com/doi/full/10.1002/chem.201901480
参考文献:
[1] C. Zhang, T. Pan, C. Salesse, D. Zhang, L. Miao, L. Wang, Y. Gao, J. Xu, Z. Dong, Q. Luo,*J. Liu,* Reversible Ca2+ Switch of An Engineered Allosteric Antioxidant Selenoenzyme. Angew. Chem. Int. Ed. 2014, 53, 13536-13539.
[2] S. Li, W. Xu, S. Chu, N. Ma, S. Liu, X. Li, T. Wang, X. Jiang, F. Li, Y. Li, D. Zhang, Q. Luo,* J. Liu. Computational Design and Study of Artificial Selenoenzyme with Controllable Activity Based on an Allosteric Protein Scaffold. Chem. Eur. J.2019, 25, 10350-10358. (InsideCover, Hot Paper)